WP3 – Radiobiologie
 Le WP3 de FranceHADRON se focalise sur la radiobiologie qui est l'étude des effets biologiques des rayonnements ionisants sur les êtres vivants et leurs cellules.
Le WP3 de FranceHADRON se focalise sur la radiobiologie qui est l'étude des effets biologiques des rayonnements ionisants sur les êtres vivants et leurs cellules.
L’IPNL (Lyon), le LPC Clermont, l’IRSN, l’EMR3738 (Lyon), l’U562 (Toulouse) l’UMR6232 (Caen), l’U612 (Orsay), l’ICPO, l’U1030 (Villejuif), le CREATIS (Lyon), et le LARIA (Caen) travaillent aux réalisations du WP3 coordonné par Mme Claire Rodriguez-Lafrasse.
WP 3.1 Méthodes pour l'acquisition de données radiobiologiques, leurs traitement, leurs analyse et leur modélisation:
Les méthodes sont maîtrisées et le travail préliminaire est en cours depuis les 2 dernières années. À la mi-2015, les résultats attendus sont les suivants:
1) Développement d'un système d'irradiation cellulaire pour les protons (1-3 MeV) y compris le suivi des trajectoires d’impact des protons via l'imagerie et les méthodes physiques;
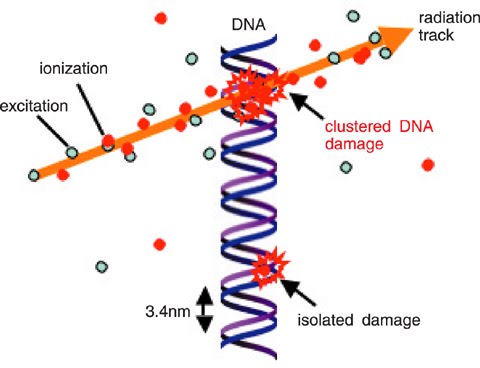
2) la mise à niveau d'un programme Monte Carlo de simulation (Geant4DNA: http://geant4-dna.org) afin de décrire les premières étapes physiques et chimiques des impacts des particules ionisantes dans une cellule à une résolution microscopique qui conduira à la simulation de dommages directs et indirects de l'ADN;
3) les corrélations entre les dépôts d'énergie simulées par code MC et les dépôts réellement obtenus. Ceux-ci sont observés à l'aide des plates-formes de microscopie d'acquisition informatisé à haut débit dans différentes lignées cellulaires tumorales humaines irradiées par des ions carbone et de protons à différent TEL. Ce travail a des liens avec WP2.
A plus long termes, le WP3 vise à développer des modèles d'EBR pour améliorer les TPS. Ces modèles seront basés sur le modèle de micro-cinétique (MCM) et sur de nouvelles approches impliquant la nanodosimétrie et la simulation du stress oxydatif.
WP 3.2.1 approche radiobiologie de l'hadronthérapie combinée ou séquentielle :
L'objectif est de développer des protocoles de chimiothérapie ou de thérapie ciblée associées avec l’hadronthérapie (témozolomide, les sels de platine, les inhibiteurs de l'EGFR, etc) ou des protocoles séquentiels impliquant photon et hadronthérapie dans différents modèles de tumeurs (glioblastome, ORL , in vitro et in vivo). Les résultats viendront enrichir les codes de simulation (WP3.1) et servir de base pour des hypothèses d'essais pré-cliniques et cliniques (WP1).
Fin 2014, les connaissances seront améliorés quant aux dommages à l'ADN, la survie et la mort cellulaire, la transcriptomique et les analyses methylomic. A la fin 2015, nous devrions disposer des premiers résultats basés sur des modèles animaux de tumeurs de glioblastomes orthotopiques et de chondrosarcomes métastasant.
WP 3.2.2 Influence de l'hadronthérapie sur la récidive, l'angiogenèse et la métastase :
L'objectif est de valider la réduction du risque de métastase et de récurrence en réponse à des ions carbone par rapport aux protons et aux photons en utilisant des modèles cellulaires de tumeur, des cellules souches cancéreuses (HNSCC, glioblastome) et des modèles animaux,. Ce travail dépendra de WP2.2 pour les valeurs de référence de l'EBR.
L’étude des radiorésistances et des mécanismes de migration cellulaire en fonction du type de rayonnement ionisant dans des modèles cellulaires sera conclue au début de l’année 2015(tests de migrations et d'invasion, les voies de signalisation, les intégrines, cadhérines, Rho-GTPases). Dans l’année suivante, sera mise en œuvre l’étude in vivo de tumeurs métastasiques orthotopiques irradiées par ions carbone, en comparaison avec des irradiations photons et protons selon différents schémas de fractionnement.
WP 3.2.3 Prédiction de la réponse tumorale :
Des études in vitro et in vivo seront réalisées afin de prédire la réponse d'une tumeur fonction d'un panel de biomarqueurs tumoraux donné. Ce travail commence par la validation de biomarqueurs au sein d’un pool de biomarqueurs candidats (le travail préliminaire d’identification est déjà réalisé) à l'aide d'immuno-histochimie et / ou d'analyses Q-PCR entreprises sur des cellules tumorales humaines in vitro, ex vivo ou issues de biopsies. Une relation avec les bio-banques sera établie. Puis, une étude biologique associée (Lyric) sera mise en œuvre conjointement à l'essai randomisé appelé PHRC-ETOILE / HIT (voir WP1) pour le carcinome adénoïde kystique et les sarcomes.
WP 3.3.1 sensibilité individuelle et les voies de signalisation/réparation suites aux dommages de l’ADN :
Les études sur la susceptibilité individuelle aux rayonnements ionisants seront étendues à hadronthérapie. Elles pourront être entreprises avec des fibroblastes humains et les astrocytes de radiosensibilité différente. Nous tacherons d’établir les relations entre l'énergie des rayonnements et la nucléo-navette du pATM. Une seconde étape sera d’identifier un lien entre le type de tissu considéré, l'expression de la pATM et la réparation de l'ADN. L'effet by-stander sera évalué dans ce contexte biologique. Enfin, les équipes impliquées chercheront une corrélation entre l'échelle CTCAE et le phénomène de signalisation/réparation.
WP 3.3.2 Toxicité des hadrons sur les tissus sains:
Les complications induites par l’hadronthérapie seront évaluées selon leur proportion, leur nature et leur cinétique de développement sur un modèle murin C57B I6.
La première étape comprend l’analyse sémiotique, l'imagerie in vivo (PET et IVIS) et anatomo-pathologie de l'apparition de complications précoces et tardives. Les conséquences de l'invalidation des voies de signalisation TGF-β et Rho dans les modèles de souris transgéniques sont analysées en termes de toxicité aiguë, chroniqu et d’impacts sur les processus inflammatoires neurotoxiques et neurodégénératifs. Un EBR pourra être créé selon les composantes cellulaires du tissu considéré (cellules endothéliales, fibroblastes, tissus musculaires lisses, cellules du cerveau, etc..). Complementary photon and then carbon irradiation (top-up) at different stages of the development of tissue damage.
WP 3.3.3 Evaluation du risque de cancer induit par hadronthérapie :
Le but ici est de comprendre et de quantifié les risques de cancérogenèse radio-induite par irradiation proton ou carbone par rapport à une irradiation par photons. Le modèle retenu dans ce cadre est le modèle murin Balb/C p53 hétérozygote. Les paramètres physiques tels que le débit de dose, l’émission de neutrons ou l’activation seront corrélés avec l'induction de cancer radio-induit dans les modèles précités. Une autre étude porte sur l’effet des fractionnements des irradiations de protons / carbones / photons portant sur différents ciblage (base du crâne et/ou des glandes mammaires) sur l'induction de la tumeur. Ces données permettront des parallèles avec les données de cohortes de patients et des modèles de risque de carcinogenèses induites.
Contact : Claire Rodriguez-Lafrasse.
Evènements FrHA
L'hadronthérapie mise à l'honneur dans le courrier du CERN avec le premier patient traité avec le nouveau Cyclotron du CAL (Nice)
8 Juillet : Réunion du conseil scientifique international - Paris
Workshops et réunions internationales
Du 18 au 23 Mai 2015: 54th PTCOG - Manchester Grand Hyatt, San Diego, California









